Adapations à la vie terrestre des Coenobitae
Les Coenobitae font partie des rares crustacés à avoir conquis la vie terrestre. Cela suppose un certain nombre d'adaptations au niveau biologique. Les Coenobitae sont composés de 17 espèces connues à ce jour (16 espèces de Coenobita sp. et le crabe des Cocotiers, Birgus Latro, le plus grand des arthropodes terrestres). Bien qu'il existe relativement peu d'espèces de Coenobita, les spécimens sont nombreux dans les zones tropicales et subtropicales, les zones supratidales maritimes, les zones intertidales (mangrove), les petites îles ... Certaines espèces restent proches de la côte (Coenobita Pelatus, Coenobita Scaevola, Coenobita Cavipes ...), d'autres peuvent rentrer assez loin à l'intérieur des terres (Coenobita Clypeatus, Coenobita Brevimanus, Coenobita Rubescens ...). L'adaptation à la vie terrestre semble être une évolution assez récente sur le plan paléontologique. En effet, les premiers fossiles connus à ce jour de Coenobita remontent au Miocène Inférieur. La famille de Coenobita est entièrement terrestre, mis à part les stades larvaires dans l'océan (voir Reproduction). La transition réussie entre la vie marine et terrestre nécessite un certain nombre d'adaptations physiologiques, certaines qui sont essentielles à la survie hors de l'eau (adaptations des branchies), d'autres qui ont pu être développées sur une période plus longue d'adaptation.
Des branchies évoluées
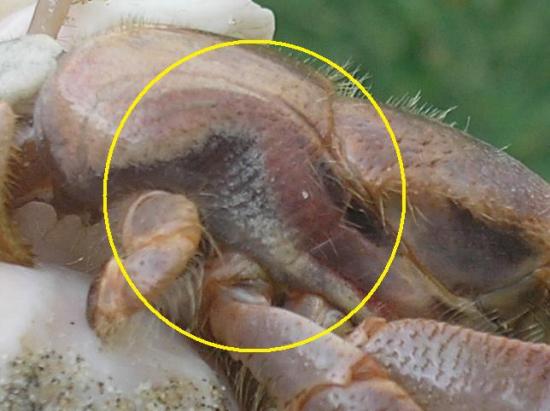
Il est évident que l’une des plus importantes adaptations à la vie terrestre chez les Coenobita est l’usage de branchies évoluées permettant la respiration à l’air libre. Pour extraire l'oxygène de l'air plutôt que de l'eau, les branchies des Coenobita sont réduites en nombre et sont solidifiées, les parois intérieures très fines de la « chambre » des branchies sont vascularisées pour promouvoir l'échange de gaz. En outre, la ventilation de la « chambre des branchies » est renforcée par les parois latérales réduites de la carapace ou du « bouclier » de la tête du Coenobita . L’humidification des branchies est favorisée par des glandes bien développées dans la région des bronches.
Réponses face à la dessiccation
-
Rôle de la coquille
Le danger de dessèchement ou de perte des liquides organiques par évaporation est le problème le plus critique face à un animal qui migre de d’une vie marine à une vie terrestre. Coenobita a un avantage à cet égard, car il peut stocker de l'eau dans la coquille de mollusque appropriée, et cette eau peut être utilisée secondairement pour la boisson. Une raison pour laquelle des bernard-l'hermite essayent si souvent de nombreuses coquilles de mollusque, abandonnées, est que ceux-ci se doivent de trouver une coquille qui correspond parfaitement à leur dimension (notamment de l’abdomen) en étroite collaboration, afin de minimiser l'évaporation.
-
Caractère nocturne
La lutte contre la dessiccation est probablement responsable des habitudes nocturnes de Coenobita, où l'activité diurne peut entraîner l'évaporation sévère. Des expériences ont montré que les animaux dans des coquilles bien ajustées peuvent subsister sans nourriture et eau six fois plus longtemps que ceux retirés de leur coquille. Lorsque le Coenobita se retire dans sa coquille dans la journée, les pinces et les jambes ambulatoires forment un joint assez efficace contre l'évaporation au niveau de l’ouverture de la coquille. Les parties de l'animal les plus en avant sont les plus fortement calcifiées, ce qui contribue certainement à éviter l'évaporation des liquides organiques. Comme beaucoup terrestres animaux, les coenobitidae peuvent modifier leur comportement afin de minimiser l'évaporation (perte d'eau), en particulier dans des conditions chaudes et sèches, caractéristiques de leur biotope, et ils sont les plus actifs pendant la nuit car on constate une nette augmentation du taux d'humidité. Ils détectent et s'orientent par rapport à la vapeur d'eau (Vannini et Ferretti, 1997) et des gradients d'humidité. C. clypeatus sélectionne les zones d'humidité maximale tout en évitant les supports mouillés (de Wilde, 1973). Bien que les espèces Coenobitae soient principalement nocturnes, des hausses soudaines durant la journée du taux d'humidité, ou une douche rapide, lancent souvent l'activité diurne (Ball, 1972; de Wilde, 1973; Vannini, 1976, Alexander, 1979).
-
Consommation d’eau et Osmolarité chez les Coenobita
Coenobita consomme l'eau en plongeant l'extrémité des pinces dans le liquide, puis transfert l’eau jusqu’aux pièces buccales (ou maxillipèdes). L’eau est ensuite transférée de là jusqu’à la bouche puis à la chambre branchiale. De très petites quantités d'eau, tels que les gouttes de pluie et la rosée, peut être utilisées de cette façon. Une autre méthode consiste à tenir les deux pinces rapprochées et les tremper dans l'eau; en provoquant des petits mouvements, l'eau est forcée de s'élever par capillarité le long de la frange de poils (setae) sur les surfaces inférieures des pattes, puis les maxillipèdes amènent jusqu’à la bouche. Coenobita a une perception sensorielle très développée pour l'eau, il préfère les eaux de faible salinité et il est capable de discriminer entre les différentes salinités. Les animaux semblent être dans le meilleur état quand une petite quantité de sel est présent dans l'eau potable. Elle est indispensable chez des espèces comme le Coenobita Perlatus. L'eau de mer (pleine de nutriments) peut être utilisée pour boire chez le Coenobita Clypeatus, mais pas pour l'eau de la coquille (contrairement à d’autres espèces), celle-ci doit être constamment diluée avec de l'eau douce afin d'éviter des concentrations différentes des fluides corporels. Pendant la saison sèche à Curaçao, la roche calcaire, contenant de l'humidité est consommée par les Coenobita Clypeatus comme une source d'eau.
La thermorégulation
Beaucoup d'espèces de Coenobita occupent des habitats de type « plage tropicale » où la haute insolation et les températures diurnes renforcent le caractère nocturne des activités du Bernard l’hermite terrestre. Là où la pluviométrie est faible ou la couverture végétale pauvre, les zones de distribution des espèces sont généralement limitées (par exemple Coenobita Scaevola sur les côtes de la mer Rouge (Achituv et Ziskind, 1985).
Des moyens comportementaux sont utilisés pour éviter la « surchauffe ». Les Coenobita recherchent les zones fraîches, les refuges humides pendant la journée sous des débris ou rochers de la plage, ou sous la litière forestière, sous les buissons et racines des arbres en haut des plages. Coenobita Scaevola et Coenobita Rugosus s'enfoncent jusqu'à 20 cm dans le sable pour éviter l'insolation directe si bien que la température corporelle dépasse rarement 35 ° C (Vannini, 1976; Achituv et Ziskind, 1985). Les espèces, vivant le plus à l’intérieur des terres, visent également durant la journée des refuges humides. Les C. brevimanus se rassemblent en groupe formant de petites grappes sous des grumes dans la forêt tropicale sur l'île Christmas et dans des tas de débris de noix de coco (Gross, 1964), tandis que le crabe de cocotier (Birgus Latro) cherche les crevasses, les formations rocheuses, les troncs creux et les arbres (Fletcher et al, 1990b;. Greenaway, 2001).
L'activité est principalement nocturne, mais commence souvent avant le coucher du soleil pendant que l'ensoleillement sera en baisse. Par temps froids, les Coenobita devenus inactifs restent enfouis dans le sable ou sous des débris (George et Jones, 1984). Bien que la thermorégulation comportementale est prépondérante dans l'espèce de la mer Rouge : Coenobita Scaevola, toute l'eau de la coquille a généralement été perdue par les BHT le temps qu’ils émergent de leur terrier à la fin du jour et leur première action est de remplir le réservoir avec de l'eau de mer(Achituv et Ziskind, 1985). L'évaporation de cette eau facilite la perte de chaleur.
Des organes sensoriels adaptés à la vie terrestre
Les animaux terrestres ont besoin principalement de la vision, l'olfaction et la détection du son afin de percevoir des informations sur l'environnement. Les organes sensoriels des espèces émergentes doivent être capables de s'adapter en fonction dans l'air plutôt que de l'eau. Les bernard-l'hermite terrestres ont mis au point des systèmes visuels et olfactifs adaptés au milieu aérien, mais semblent montrer moins dépendance à l'égard de son. En dépit de modifications fonctionnelles des systèmes sensoriels, l'anatomie du cerveau reste similaire aux espèces aquatiques et terrestres d'Anomoures (Sandeman et al., 1993). Coenobita Rugosus a des crêtes sur la pince gauche et le deuxième péréiopode gauche ce qui ressemble à un appareil stridulatoire (Vannini, 1976), et ceux-ci ont également été observés chez plusieurs autres espèces (A. W. Harvey, comm. pers.). L'espèce est signalée comme capable de produire des sons ressemblant à des gazouillis (Borradaile, 1903). Coenobita purpureus (Stimpson, 1838) émettent des sons (Imafuku et Ikeda, 1990), comme le fait C.violascens (Heller, 1852) lorsqu'il a été capturé (Nakasone, 1988a). Birgus latro a été signalé à faire un son continu "tic-tac" (Grubb, 1971), mais il n'y a pas d'autres documents de la production sonore par les espèces, et Grubb (1971) a détecté l'activité scaphognathite qui peut être audible. Comme certaines espèces de Coenobita émettent des sons, il est probable qu'ils possèdent aussi des récepteurs sonores, mais, bien qu'il y ait des rapports anecdotiques de sensibilité au bruit (Borradaile, 1903), les vibrations de détection et le visuel ne peut pas être exclus de cette analyse. Vannini (1976) a suggéré que l'orientation des migrations transdunales de C. rugosus peut être induite par le bruit ou les vibrations, générées par les vagues. Coenobitida ont des yeux similaires à ceux des autres arthropodes diurnes (Spears, 1983).
La vision est évidemment un sens important comme l'a démontré certains comportements, mais jusqu'à présent il n'y a pas d'études physiologiques sur la vision.
L'olfaction est très développée et réalisée grâce aux antennes. Celles-ci sont en mouvement constant lorsque la palpation des Coenobita est active. Les mouvements permettent de maximiser le volume d'air de l'échantillon analysé et donc fournir des informations directionnelles sur les sources d'odeurs environnantes. Les premières antennes de Coenobitida diffèrent de celles des décapodes aquatiques. Comme les jonctions basales sont assez longues, cela permet aux deux flagelles sensibles au toucher de "goûter" le sol ainsi qu'un grand volume d'air au-dessus et autour du Coenobita. Les unités sensorielles (aesthétasques) du C. compressus sont courtes et bien dessinées. Elles sont plus semblables à celles des insectes terrestres que de ceux des décapodes aquatiques, y compris les bernard-l'hermite aquatiques. Il y a une sorte de convergence évolutive. Ces différences sont dues à l'adaptation pour la détection de substances chimiques volatiles dans l'air et peut-être avec restriction de la perte d'eau « antennulaire » (Al Ghiradella et al. 1968a; 1968b). L'espèce Compressus semble également montrer une absence d'aesthétasques sur les dactyles alors qu'elles sont présentes chez les décapodes aquatiques. Les Coenobitae (Coenobita et Birgus Latro) identifient les aliments à distance et s'agrègent autour des sources alimentaires importantes. Le crabe des cocotiers (Birgus Latro) semble particulièrement efficace pour détecter les noix de coco ouvertes, le fruit du sagoutier et autres fruits exotiques. Il a également la faculté de détecter rapidement les charognes en décomposition. Coenobita Cavipes est attiré par différentes variétés d'odeurs de nourriture volatiles mais ne peut détecter les aliments non volatiles que par contact (Rittschof et Sutherland, 1986). Coenobita peut aussi détecter la vapeur d'eau et les espèces qui pénètrent à l'intérieur des terres, tels que C. rugosus et brevimanus C., peuvent faire la distinction entre l'odeur de l'eau douce et eau de mer. Ce sens est peu développé sur la plage par les espèces de la côte telles que C.Cavipes et C. perlatus (Vannini et Ferretti, 1997).
Lorsque des individus sont nombreux autour d'une source de nourriture, l'emplacement des alimentaire peut être facilitée socialement. Les animaux localisent en effet les sources d'aliments en observant le comportement de leurs voisins, plutôt que par détection de la nourriture en soi (Kurta, 1982).
Les Coenobitida sont caractérisés par le maintien de la longue paire d'antennes filiformes (latérales) retrouvés chez les Anomures aquatiques. Elles sont très mobiles et semblent être utilisées pour étudier et localiser les objets solides dans l'environnement d'une manière similaire à celle de leurs proches parents aquatiques. Il n'y a eu aucune étude spécifique sur leur rôle chez les Coenobitidae.
Le Bernard l'hermite terrestre possède une capacité considérable à s'orienter, à naviguer (Vannini et Cannicci, 1995). Coenobita Clypeatus, par exemple, ont quelques sites de reproduction préférés vers lesquels ils migrent à partir de vastes étendues de l'arrière-pays (de Wild, 1973). Les populations de C. Rugosus peuvent occuper un "espace d'accueil" distinct dans lequel ils restent pour des périodes d'un an ou plus. Il n'y a pas occupation d'une place d'accueil spécifique (Vannini, 1976). De même, les Diogenidae aquatiques, comme Clibanarius laevimanus (Randall, 1840), se concentrent dans les mangroves durant des périodes de recherche de nourriture, et restent dans une zone d'accueil, même si elle peut changer (Gherardi et Vannini, 1992). Coenobita Rugosus s'oriente selon des repères visuels (si repères visibles), et dans des environnements uniformes, il utilise des repères célestes. L'orientation pour localiser la zone d'habitat principale en utilisant des repères célestes nécessite un apprentissage, notamment sur une île ou un atoll et donc dans n'importe quelle direction (Vannini et Chelazzi, 1981). Les Coenobita sont également sensibles aux mouvements d'air directionnel, et en l'absence d'autres indices, ils peuvent utiliser les vents comme une source de direction informations pour la navigation (Vannini, 1975a; Vannini et Chelazzi, 1981; Vannini et Ferretti, 1997).
Locomotion et mouvement
Bien que les Coenobitida semblent lourds et généralement portent de lourdes coquilles de mollusques, ils ont une capacité locomotrice très importante (Herreid et Full, 1988) et sont souvent d'excellents grimpeurs au niveau des arbustes, arbrisseaux et arbres en tout genre (Barnes, 1997b; von Hagen, 1977). La forme bombée de l'animal permet de grimper avec les pinces et les dactyles des péréiopodes (cela fait une sorte de "crochet " autour de petites branches ou de surfaces d'adhérence non lisses). Birgus Latro (crabe de cocotier) utilise les terminaisons tranchantes (en forme d'aiguille) des dactyles de ses pattes ambulatoires afin de grimper sur l'écorce des troncs d'arbres ou sur des irrégularités dans de grandes surfaces rocheuses. Ils peuvent donc se hisser et se suspendre au niveau de la végétation grimpante et des rochers environnants. Les pattes ambulatoires lourdement calcifiées peuvent facilement supporter le grand corps du Crabe de Cocotier (Birgus Latro) bien qu'au repos, le corps est en contact avec le sol par l'abdomen. Les Coenobita utilisent leurs pinces et les deux paires suivantes de péréiopodes dans la locomotion. Une démarche alternative de trépied est normale, avec une poussée vers l'avant en grande partie assurée par les péréiopodes secondaires (R2, L2) tandis que les premiers péréiopodes (pinces) sont principalement utilisés dans soutien. L'abdomen et la coquille de mollusque sont généralement élevés au-dessus du sol durant la locomotion mais les coquilles lourdes doivent parfois être trainées. Au repos, la coquille est à même le sol (Herreid et Full, 1986a).
Les Bernard l'Hermite terrestres sont capables de se mouvoir de façon soutenue à une vitesse de marche assez lente. Des voyages jusqu'à 500 m en une seule nuit ont été enregistrés lors des migrations de reproduction (de Wilde, 1973). La recherche de nourriture par les Coenobita, sur la plage, où la nourriture et l'eau sont co-localisés, est demande un déplacement généralement peu important, ils se déplacent le plus souvent à l'intérieur un rayon de 30 m et peuvent avoir des "sites d'accueil " où ils élisent domicile (Herreid et Full 1986a; Brodie, 1998). Lorsque la nourriture et les sources d'eau sont séparées, les animaux peuvent migrer durant la nuit (par exemple, C. rugosus), mais des incursions intérieures plus longues ne se font que lorsque les animaux ont une source d'eau proche ou conditions humides (Vannini, 1976). Birgus Latro (Crabes de Cocotier) ne sont pas fixés dans leur recherche de nourriture modèle et semblent avoir un certain nombre de sites d'accueil entre lesquels ils se déplacent. D'autres fois, ils semblent être nomades, et les animaux (fichés par radio-émetteur) peuvent se déplacer aussi bien à 500 m à travers la forêt pluvieuse en 24 h (Fletcher et al., 1990b; Greenaway, 2001) pour repérer les arbres à fruits.
Les changements physiologiques, morphologiques et comportementaux pour l'adaptation à la vie terrestre.
|
Fonction Physiologique : |
Modifications physiologiques exigées ou adaptations morphologiques à l'émersion ? |
Niveau d'adaptation à la vie terrestre pour lequel cela est essentiel |
|
Consommation d'oxygène |
Oui, des modifications morphologiques immédiates sont exigées. |
T1 |
|
Sortie de C02 |
Oui, exigence nécessaire. |
T1 |
|
Régulation du sodium |
Non, si de l'eau de mer est régulièrement disponible pour l'immersion. |
T3-T4 |
|
Perte d'eau par évaporation |
Non, si de l'eau est disponible dans le microhabitat. |
T4 |
|
Excrétion d'azote |
Non, si les périodes d'immersion sont relativement brèves. |
T4 |
|
Régulation de la température |
Non, si la température de l'animal peut être régulée par son comportement si de l'eau et des abris sont disponibles. |
/ |
|
Réception sensorielle |
Son : Adaptation non immédiate. Vision : Immédiate. Chimique : Perte de la perception chimique aquatique compensées par la vision. |
T3 T2 T2-T3 |
|
Locomotion et support |
Non, pré-adaptée à la locomotion terrestre ou utilisation de coquilles de mollusques. |
T2 |
|
Mue |
Non, pas si l'animal peut muer dans l'eau. |
T4 |
|
Reproduction |
Oui, il faut certains changements de comportement et souvent des modifications physiologiques et morphologiques. |
T1-T5 |
Peter Greenaway, 1999.
Légende : L'indice T montre le niveau d'adaptation à la vie terrestre. Plus il est élevé, plus l'espèce est adaptée à la vie terrestre. T5 étant le maximum (toutes les activités biologiques étant conduites sur la terre).
Commentaires
-

- 1. Marikar Le 27/11/2015
Effectivement c'est plutôt pour ressortir de mue que ça doit être le plus difficile : une coquille déjà bien trop grande avant doit être encore plus difficile à manoeuvrer à la sortie, pleine de sable, par un coco encore un peu raplapla ;-) -

- 2. Fitis Le 26/11/2015
Ce qui est écrit dans cet article reste une généralité bien sûr. Forcément, certains spécimens ont des coquilles trop grandes ou trop petites selon les disponibilités et leurs préférences. Une grande coquille est déjà moins à risque de dessiccation qu'une petite. On peut extrapoler que c'est aussi le gage d'une croissance optimale pour la suite (le lien entre la taille de la coquille et la vitesse de croissance a été prouvé). J'ai aussi un C.clypeatus qui avait pris une coquille gigantesque et a dû remonter à la surface sans celle-ci après sa mue. Parfois, il faut bien le dire : ils ont les yeux plus grands que le ventre ! ;) -

- 3. Marikar Le 26/11/2015
[quote][/quote] Une raison pour laquelle des bernard-l'hermite essayent si souvent de nombreuses coquilles de mollusque, abandonnées, est que ceux-ci se doivent de trouver une coquille qui correspond parfaitement à leur dimension (notamment de l’abdomen) en étroite collaboration, afin de minimiser l'évaporation.
Comment expliquer alors qu' un de mes clypeatus ait emménagé dans une coquille de bulot démesurément grande par rapport à sa taille, alors qu'il en avait plein d'autres disponibles ?
Parce qu'il aime les grands appart et qu'il ne craint pas une baisse éventuelle de l'hygro dans son terra ?
Ce que je crains, c'est qu'il peine à s'enterrer pour muer !
Mais bon, c'est lui qui voit... -

- 4. Alexia Le 17/03/2013
Très bon site!
Vous devez être connecté pour poster un commentaire